【研究背景】
众所周知,伤后皮肤完整性、内环境稳定和保护功能的恢复对人类的生命健康至关重要。并且对于慢性或非愈合性伤口,由于损伤部位的氧化应激过多严重阻碍了愈合,需要长期的治疗和护理。伤口处活性氧(Reactie oxygen species,ROS)的大量积聚会导致严重的炎症反应,降低内源性干细胞和巨噬细胞对皮肤组织再生能力,抑制伤口的修复。此外,ROS会抑制新生血管的形成,导致内皮细胞的功能障碍。因此,皮肤损伤和伤口感染产生的活性氧过多而未被及时清除,会阻碍伤口愈合的进程。无论是改变封闭伤口的方法还是防止感染,伤口治疗的目标归根结底都是实现有效和安全的闭合。到目前为止,主要的伤口修复手段包括压迫绷带,伤口敷料,高压氧治疗,负压治疗和超声波等。然而,这些被动治疗方法很少参与内源性组织修复,且忽视了易感创面ROS的清除,因此不能有效地促进创面愈合。尽管最近兴起的生长因子介导疗法已成为另一种皮肤创伤愈合再生的有效途径,但仍存在诸如降解快和生物活性易丧失的弊端。近年来,电刺激作为一种极具特色的促进伤口愈合的辅助方式备受研究者青睐。据报道,电刺激的组织修复机制类似于内源性电场,而内源性电场对于指导成纤维细胞增殖、表皮细胞迁移和刺激受体部位接受某些生长因子以促进有序的皮肤再生至关重要。尽管这种方式的治疗效果显著且不良反应较少,但需要提供合适电场的大型体外仪器,当电刺激被用于临床时,患者甚至需要住院治疗。值得庆幸的是,便携式和可穿戴式电子器件已快速兴起,特别是应用于更好更快的体外诊断测试和疾病的即时检测。但是目前便携式医用传感器件通常由外置电源或可充电电池供电,具有使用寿命有限、充放电效率低、存在潜在的二次污染等缺点。
近日,东南大学生物科学与医学工程学院葛丽芹教授课题组和中大医院重症医学科刘玲教授合作,设计具备环境友好型-可持续供电和有效清除ROS能力的新型智能医疗器械加快伤口愈合。该研究通过层层自组装方法制备出了一种人体运动驱动的自供电纳米复合“修理器”,用于电刺激内源性伤口愈合及生理环境响应性清除活性氧,缓解体内炎症反应(ToC图)。与传统的被动治疗方式相比,这种模式提供了一种集运动信号转化为电信号和pH响应性层层自组装薄膜于一体的有效愈合创面的新策略,无疑为患者带了福音。
【图文详解】
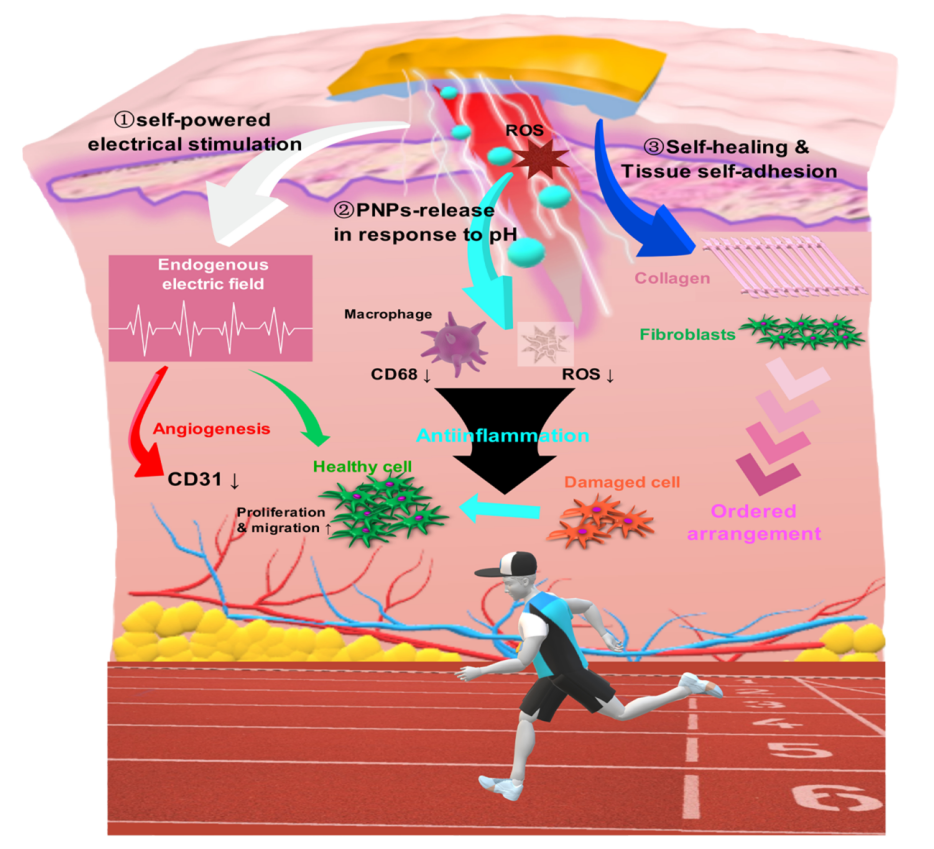
ToC 图 运动驱动的层层自组装“修理器”,用于自供电刺激内源性伤口愈合及生理环境响应性抗炎的相关机制。
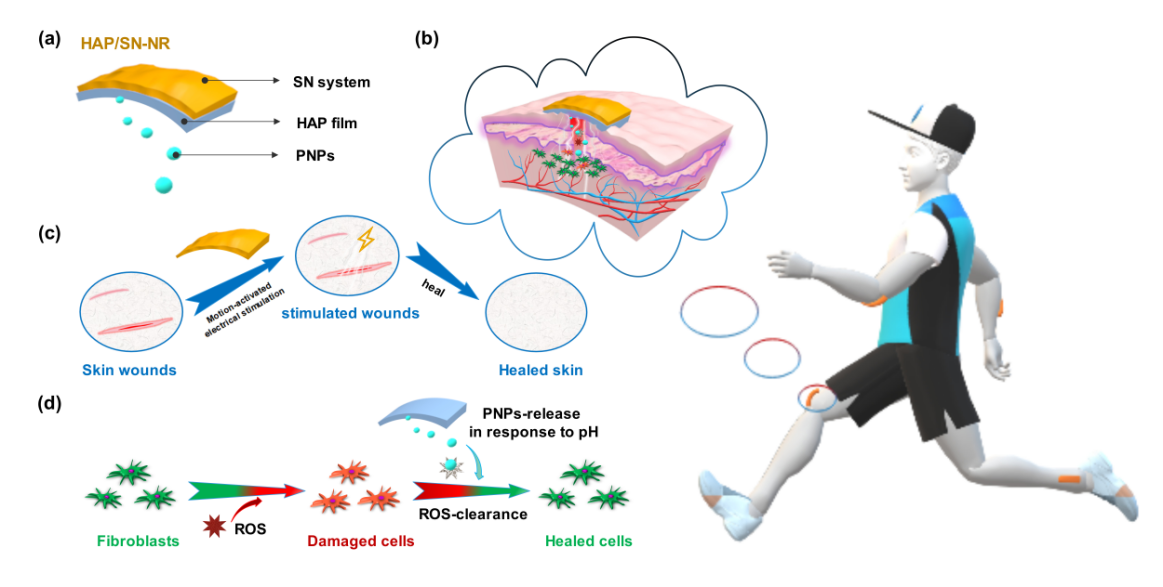
图 1 生物力学运动驱动自供电LBL纳米复合“修理器”用于伤口愈合。(a) HAP/SN是由多层薄膜(HAP)和自供电纳米发电机(SN)组成的;(b)受伤人员行走时佩戴HAP/SN医疗器件,插图:自供电刺激和纳米颗粒的响应性释放协同促进受损组织的有效愈合示意图;(c) SN 系统在运动的激活下电刺激使受损皮肤康复;(d)HAP层层自组装薄膜用于pH-响应性清除ROS使成纤维细胞恢复到正常的生长状态。
在这项工作中,该课题组致力于设计一种基于摩擦电纳米发电机和治疗性纳米颗粒响应性释放模型的便携式自供电纳米复合伤口“修理器”。将逐层涂覆2-羟丙基三甲基氯化铵-壳聚糖(HTCC)、海藻酸钠(ALG)和聚多巴胺/Fe3+纳米颗粒(PFNs)组装的膜与通过生物力学运动驱动的自供电纳米发电机(SN)组合到纳米复合修复器(HAP/SN-NR)中(图1a,b)。这个位于HAP/SN-NR顶层的SN系统可以提供适当的电场强度,刺激表皮再生,有利于血管生成和皮肤的快速主动愈合(图1c)。更重要的是,受基于摩擦带电的接触分离型纳米发电机的启发,我们已经证明SN作为一种可持续的可穿戴传感器可以将人体运动的生物力学信号转换为电信号。由运动驱动的SN系统产生的电场对伤口康复有积极作用。另一方面,在HAP/SN-NR的底层负载PFNs在体内外均能快速响应pH去除ROS。值得注意的是,当正常皮肤组织受损产生炎症时pH值会发生明显变化(趋于从中性向弱酸性转变),HAP膜上的PFNs可敏感性地释放聚多巴胺纳米粒到损伤部位,清除体内ROS,消除炎症(图1d)。实验表明HAP/SN-NR的HAP膜除了具有pH响应清除活性氧性能外,还具有高的组织自粘附性,紧密地封闭伤口;优异的自修复性,以增强其耐久性;良好的生物降解性,降低了伤口闭合后二次剥离造成损伤和感染的风险。并且在动物伤口模型实验中,我们的HAP/SN-NR不仅通过其绿色可持续的电刺激促进了成纤维细胞的体外增殖和迁移,而且促进了新生血管的形成,与商用的TegadermTM film相比,有效促进了伤口的修复,且没有明显的炎症反应。
本研究的目的是提供一种新型有效的伤口愈合策略,以一种便携式智能敷贴的形式,即生理环境性响应性清除ROS,无需电池,将人体运动与临床康复护理有机结合,其应用方式简便、治疗效果显著。
该研究论文以“Biomechanical motion-activated endogenous wound healing through LBL self-powered nanocomposite repairer with pH-responsive anti-inflammatory effect”为题于2021年10月在期刊《Small》上在线发表,东南大学生物科学与医学工程学院为本研究第一完成单位,博士生苑仁强为第一作者,葛丽芹教授和刘玲教授为该论文共同通讯作者。
文献链接:Renqiang Yuan,Ling Liu,Liqin Ge,et al. Biomechanical Motion-Activated Endogenous Wound Healing through LBL Self-Powered Nanocomposite Repairer with pH-Responsive Anti-Inflammatory Effect. Small, e2103997 (2021).
DOI: 10.1002/smll.202103997
